編集部あなんの茶のみ話、前回の続きです。
1.電池による発電
レモンや備長炭で発電できるって、どういうこと?を書いてみようと思います。
いろいろ調べてみると、発言者によって言語が少しずつ違う場合があり、素人は混乱します。電子を受け取るとか、電子を放出するとかいいますが、何が何から受け取るの?何がどこへ放出するの?というベタなことを考えながらしか理解できない。中学生向けでは話がはしょられすぎ、高校生向けでは元素記号や式がでてきて複雑すぎ。そんな頭を使ってシンプルに書き出すのに苦労します(複雑になると私学文系脳が拒否反応を起こすんです)。
よくあるレモン電池で考えてみます。そもそもレモンの果汁には、いろんなイオン(電荷を帯びた原子)が含まれていて電気をよく通すとのこと。これが世に言う電解質。
この電解質にぐさっと刺してあるのが、前回の例ではアルミ板と銅板。別の実験では亜鉛と銅板だったりします。この二つの金属には、どんな違いがあるのでしょう。アルミ版と亜鉛版のセットではダメなんですか。
レモンは酸っぱい。この酸で金属が微妙に溶けますよね(アルミなんて、いかにも溶けそう)。金属は、溶けるときにマイナスの電気をもつ電子(電気のもと)を出し、プラスのイオン(電荷を帯びた原子)になります。その「なりやすさ」が金属によって違うんです。これをイオン化傾向って言うんでしたっけ?ですよね。
引用
金属(金属単体の原子)が水または水溶液中で陽イオンになろうとする性質のことをイオン化傾向といいます。
イオン化傾向の大きな金属ほど、相手の物質に電子を与え、自分自身は電子を失い陽イオンになりやすくなります。つまり、イオン化傾向の大きな金属ほど、酸化されやすく強い還元力を持ちます。(引用ここまで)
ここでは、アルミ(または亜鉛)のほうがイオン化傾向がはなはだしい。そこへいくと、銅はそうでもなく、不動の銅であります。このように傾向にはっきりと差がないと電池にはならないのですよ。アルミと亜鉛では差が少なすぎるのでしょう。
さあ、レモンに刺したアルミのほうは、電子を手放して陽イオン化したでしょ。この陽イオンがレモン果汁の中に溶け出すんです。溶けるとはこれらしいです。電子を放出した金属としてのアルミのほうは、(もともと電荷のバランスがとれていたのに陽イオンだけがレモン果汁に溶けたので)マイナスに帯電した電子が残っている状態。これが線をつたって銅のほうへ流れる。電子が流れる=電気。電気が流れるとは、電流。そして発電。
わたしの間違いポイント。電子のほうがレモン果汁に溶け出したのかと思った。放出なんて書いてあると、そんな気がした。しかし溶け出すのは陽イオンのほう。アルミに残るのがマイナスに帯電した電子だった。
さて、銅の方は?電子が溜まっていくんですかね。そうだとしたら、限界はあるのかなあ。この化学反応が終わるくらいまでは溜める能力があるのかなあ(まだ説明できません)。いったん、そういう理解で進めます。
さて、わたしが電池を理解するにあたって、ちょっとびっくりしたことがあります。電子が流れる始発駅(アルミ)のほうがマイナス極。電子が溜まる終着駅(銅)のほうがプラス極。電流はプラスからマイナスに流れると習いましたよね。
でも!電子はマイナスからプラスに流れているんです。プラス極である銅のほうに電子が集まっているんです。
電子の流れと電流の流れは逆なんですよ。これは、電池の仕組みを知っている人には当たり前なのでしょうけれど、わたしなんかはもう、既成概念が壊れました。知らなかった(知ろうとも思っていなかった)。電子が集まるということの効果?意味?は、後に自分にとって重要なことになっていくんです。けど、ここではややこしくなるのでやめます。ただ、電子の流れはマイナス極からプラス極へ向かうんだと、これは覚えておかなくてはならないと思った次第です。
レモン果汁の中に溶け出した陽イオンはどうなっていくのか。これはわたしには、まだわかりません。誰か教えて。
銅イオンに引っ越した電子のほうは、レモン果汁の中に含まれる水素イオンとくっついて、れっきとした水素になられるそうです(気化)。
ここまできたら、あとはこれと同じ原理で乾電池ができているということになります。果汁ポタポタのレモンのかわりに、乾いた電解質(二酸化マンガンのまざりもの)と、マイナス極に亜鉛、プラス極には炭素棒が使われているとのこと。マイナス電極に亜鉛だけでなくマグネシウムであるとか、プラス電極に炭以外の何かとか、よりパワフルになるようなバリエーションがあるってことでよろしいでしょうか。リチウム電池だったら、マイナス極にリチウム、プラス極に二酸化マンガン。元素名を読むだけでイオン化傾向がピンとくる人はわかりやすいんでしょうね。
わたしの場合は、リチウムといえば産出国をめぐる利権争いや労働搾取や環境破壊になるのではないかと、そのほうが気になりますけど。。。
ここまで調べてみて、乾電池のプラス極は、銅ではなくて炭素棒だったということに、ちょっとほっこりしています。
備長炭電池も、備長炭がプラス極、アルミがマイナス極、塩水が電解質ですね。
備長炭電池の参考にこちら(自分のためにもリンクしておきます)
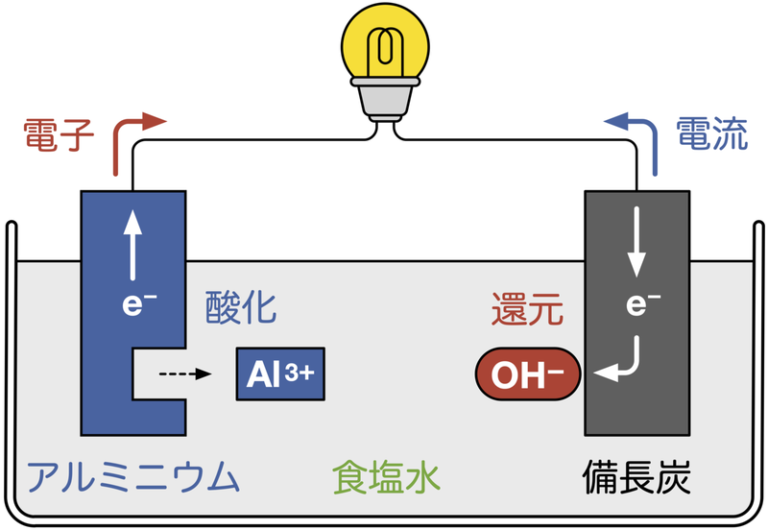
レモンのほかにじゃがいもなどの野菜でも発電するとのこと。かなり、いろんなものから発電はできるんですよね。電子はそのへんにいっぱい散らばっている。それを一定の方向へ、どれだけパワフルに流せるか、なんですね。なになにじゃないとダメ!という話ではない。これには目を見開かされた思いです。
そうなってくると、植物発電にもプラス極、マイナス極、電解質があるのではないでしょうか。次回は2.微生物による発電のことを書いてみたいと思います。いやあほんとに、今回も最後まで読んでいただいて、とっても嬉しいです。ありがとうございました。
(2微生物による発電のところ、最初の投稿では間違って植物による発電と書いていましたことを訂正・更新しています。ご了承ください)







